研究・開発の窓 COLUMN
次世代の個別化がん免疫治療「ネオアンチゲン・ワクチン、TCR-T細胞治療」の開発に挑む
垣見和宏氏(東京大学医学部附属病院/近畿大学 教授)
 免疫チェックポイント阻害薬(ICI)の登場以降、がん免疫治療が脚光を浴びているが、患者ごとに固有のがん抗原を標的とする個別化がん免疫治療「ネオアンチゲン・ワクチン、T細胞受容体遺伝子導入T細胞治療(TCR-T細胞治療)」の開発を進めている研究者が垣見和宏氏(東京大学医学部附属病院免疫細胞学講座特任教授/近畿大学医学部・大学院医学研究科免疫学教室主任教授)だ。
免疫チェックポイント阻害薬(ICI)の登場以降、がん免疫治療が脚光を浴びているが、患者ごとに固有のがん抗原を標的とする個別化がん免疫治療「ネオアンチゲン・ワクチン、T細胞受容体遺伝子導入T細胞治療(TCR-T細胞治療)」の開発を進めている研究者が垣見和宏氏(東京大学医学部附属病院免疫細胞学講座特任教授/近畿大学医学部・大学院医学研究科免疫学教室主任教授)だ。
垣見氏が研究生活に入った1990年代は、肝炎ウイルスの研究が飛躍的に進んだ時代だ。大学院で肝炎ウイルスの研究をしようとしていた垣見氏に、指導教官は「血清を使ったウイルス研究は世界中で行われているので、君は細胞を研究しなさい」とアドバイスしたという。
肝炎患者の血液からリンパ球を分離して冷凍保存しながら「これでどんな研究ができるのか」と悩んでいた頃に、垣見氏は1本の論文と出会った。肝炎で認められる肝障害はウイルスによる感染細胞の破壊ではなく、ウイルスに対する細胞性免疫応答が引き起こすものだという内容であり、これに魅了された垣見氏は論文の著者である米国Scripps研究所Chisari博士の下に留学し、細胞性免疫応答の研究を進めるようになった。
留学中には、「B型肝炎ではHBVを認識したCTL(細胞傷害性Tリンパ球)がサイトカインを放出して効率的にウイルスを破壊することが知られていたが、NKT、マクロファージ、NKなどの他のリンパ球も活性化すればサイトカインを放出してウイルスを攻撃すること、好中球や多核白血球は逆にリンパ球の攻撃を邪魔することなどを明らかにしてきた」という。
また、B型肝炎、C型肝炎などの慢性感染症では、長期化すると過剰な免疫反応を抑制する、がんの免疫チェックポイントと同様のメカニズムが働くことも分かってきた。
ウイルス性肝炎はインターフェロンや抗ウイルス薬で治療することが可能になってきたため、垣見氏は帰国すると「肝炎に対する免疫応答の研究から学んだことを、がんに応用したい」と考え、研究の対象を肝炎からがんに移した。
担癌マウスモデルを用いた細胞性免疫応答の解析から始まり、樹状細胞ワクチン、ペプチドワクチンなどを用いたがん免疫治療の開発を目指した。2000年頃のがんワクチン治療は期待されたほどの効果を示すことができなかったが、垣見氏はその理由を「抗原特異的T細胞などの攻撃を邪魔する要素があるからだ」と考え、腫瘍内の免疫応答を解析する研究を進めた。
「腫瘍はがん細胞だけでなく、さまざまな細胞で構成される。線維芽細胞があると活性化T細胞が腫瘍内に入りにくくなるし、制御性T細胞、M2マクロファージ、MDSCなどは免疫を抑制する方向に働く。腫瘍を構成する細胞は個人差があり、有効性の高いがん免疫治療を開発するには患者ごとに腫瘍内免疫抑制性環境を解析する必要がある」と垣見氏は説明する(図1)。
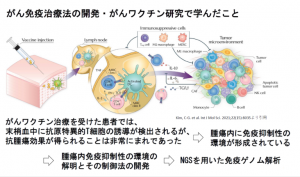
腫瘍内免疫環境をレーダーチャートで可視化
ICIはがん細胞が免疫逃避を図るメカニズムを阻害し、T細胞を再活性化するが、ICIへの反応性には個人差がある。その原因も「腫瘍内免疫環境の違いにある」と垣見氏は指摘する。
現在、進めている垣見氏の研究の一つが、次世代シーケンサーを用いた腫瘍内細胞の網羅的遺伝子解析の結果から、T細胞、抗原提示細胞、免疫抑制細胞などに関する遺伝子情報を抽出し、それぞれスコア化してレーダーチャートとしてまとめる「イムノグラム=Immunogram」(図2)の開発である。

「現状では、臨床医はT細胞やPD-L1、がん抗原の遺伝子発現の状態によってICIが奏功するかどうかを判断しているが、薬剤やがん種ごとに関連が深い6~8項目程度の腫瘍内免疫環境の要素をレーダーチャートで可視化し、治療選択の参考に判断できるように研究を重ねている」と垣見氏は話すとともに、「実際に胃がん患者31例のイムノグラムを作成すると一人一人違ったチャートになった。ICIに加え、個々の患者に合わせて最適な薬剤を併用するという戦略が有効だと考えられる」と続ける。
こうした研究を経て、垣見氏はネオアンチゲン・ワクチンおよびTCR-T細胞治療の開発を目指すようになった。ネオアンチゲンは腫瘍特異的な遺伝子変異により生じた産物で、T細胞が攻撃の目印とするがん抗原である。
ネオアンチゲンは、多くのがん患者が共通に有するEGFRやKRASなどのドライバー変異由来抗原が理想的ではあるが、多くの場合は、患者固有のパッセンジャー変異由来の抗原である。
ネオアンチゲン・ワクチンはがん患者の血液の遺伝子解析により個々の患者に応じたがん抗原を特定し、体の中でネオアンチゲンを攻撃するT細胞をつくらせようとする治療である。
一方、ネオアンチゲンを認識するT細胞受容体をクローニングして、体外でリンパ球に遺伝子導入し、体内に戻すという治療法がTCRーT細胞療法である。
「例えば、肺がん患者の変異遺伝子が100個あったとすると、10個はEGFRのような多くの人に共通する変異であり、残り90個は個人ごとに異なる遺伝子変異である。次世代シーケンサー技術の登場で、一人一人の患者の腫瘍の遺伝子変異を解析することが可能になった。
個々の患者で遺伝子変異に基づくネオアンチゲンを同定し、実際にそのネオアンチゲンに反応するT細胞からTCR遺伝子をクローニングして、遺伝子導入技術や遺伝子編集技術を用いてネオアンチゲンを認識してがん細胞を攻撃するT細胞を大量に作製し、治療に用いようと計画している」
垣見氏らはネオアンチゲンとそれに反応するTCRの遺伝子ライブラリを構築し、個別化医療ではあるが、同じ遺伝子変異を持つ患者の治療に役立てるようなシステムを構築したいと考えている。
また、従来は樹状細胞やペプチドでワクチンを作成してきたが、mRNAワクチンの研究者との共同研究を開始。樹状細胞、ペプチド、mRNAでそれぞれ作成したネオアンチゲン・ワクチンを動物実験で比較したところ、mRNAワクチンが群を抜いて優れた結果を残したという。
2023年の米国がん学会(AACR)では、メルクとモデルナが共同で進めている、mRNAワクチン技術を応用した個別化ネオアンチゲン・ワクチンとICIの併用療法がP2b試験で良好な成績を収めたという報告が注目を集めた。
「個別化医療は製造と開発のコスト、レギュレーションなどの問題があり、日本の企業はこれまであまり関心を示さなかったが、mRNAワクチンだけでなく化学合成、DDSなどの研究者との共同研究を進め、早期の実用化を目指したい」と垣見氏は話している。
関連商品
過去の記事
-
最先端のプロテオーム解析技術を用いて、進行胃がんの新たな治療標的を同定

国立研究開発法人 医薬基盤・健康・栄養研究所 創薬デザイン研究センター 副センター長 足立 淳氏(創薬標的プロテオミクスプロジェクト) -
研究機関の培養細胞の4分の1が

マイコプラズマに感染、定期的な検査が必須
医薬基盤・健康・栄養研究所 創薬資源研究支援センター長 小原有弘氏 -
薬物動態を解析するマルチ臓器モデルとMPSの冷蔵流通技術の開発を推進

群馬大学大学院 理工学府 教授 佐藤記一氏 -
カロリー制限による老化抑制の新たな分子メカニズム発見

東京理科大学教授 樋上賀一氏(薬学部 分子病態・代謝学研究室) -
遺伝子を使って花や野菜や果物を自由にデザインする

名古屋大学 准教授 白武勝裕氏(大学院生命農学研究科 園芸科学研究室)




