研究・開発の窓 COLUMN
老化抑制の鍵を握るオートファジーの活性を制御し、加齢性疾患の予防や治療につなげる
奈良県立医科大学 オートファジー・抗老化研究センター長 中村修平氏
オートファジーの活性化は寿命延長のコアメカニズム
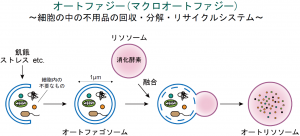
 2024年4月、奈良県立医科大学に「オートファジー・抗老化研究センター」が設立された。同センターのセンター長を務める中村修平氏(生化学講座教授)は、老化とオートファジーの関連を解明し、加齢性疾患の発症や進行の抑制を目指す研究者だ。オートファジーは真核生物において、細胞内で不要となったタンパク質を回収・分解・リサイクルするシステムである。不用品を二重膜で包み込んだ直径1μm程度のオートファゴソームが出現し、消化酵素を含んだリソソームと融合することで内包物を分解し、再利用可能にする。
2024年4月、奈良県立医科大学に「オートファジー・抗老化研究センター」が設立された。同センターのセンター長を務める中村修平氏(生化学講座教授)は、老化とオートファジーの関連を解明し、加齢性疾患の発症や進行の抑制を目指す研究者だ。オートファジーは真核生物において、細胞内で不要となったタンパク質を回収・分解・リサイクルするシステムである。不用品を二重膜で包み込んだ直径1μm程度のオートファゴソームが出現し、消化酵素を含んだリソソームと融合することで内包物を分解し、再利用可能にする。
中村氏は「オートファジーという現象は1950年代には電子顕微鏡で観察されていたが、2016年にノーベル賞を受賞した大隅良典先生が、酵母の研究からオートファジーに必須な因子(Atg)の遺伝子を同定したことがブレイクスルーとなった。大隅先生が見つけたAtgの多くがヒトを含めた哺乳類にも存在していたことから、世界中でオートファジーの制御メカニズムや生物学的な役割を調べる研究が飛躍的に進んだ。今日では、オートファジーがありとあらゆる生命現象に関与することが分かってきている」と話す。
中村氏によると、オートファジーの生物学的な役割は大きく分けて3つある(図2)。
①細胞成分の代謝回転――細胞成分を常に少しずつ分解し、再合成して入れ替え、新品に保つ
②有害物の隔離除去――侵入した病原体や傷ついたミトコンドリアなどを隔離、除去することで細胞を保護する
③栄養源の確保――飢餓、低酸素などのストレス時に細胞内成分を分解して栄養源とする
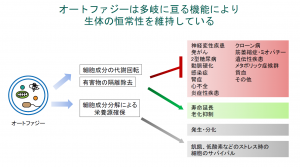
中村氏は、「特に、オートファジーによる細胞成分の代謝回転と有害物の隔離除去が、神経変性疾患、がん、2型糖尿病、動脈硬化、感染症、心不全、炎症性疾患などさまざまな疾患の発症や進行を抑制に重要な働きをもつことが、この20年ほどの間に分かってきている」と現状を説明する。その上で、「私自身は動物の寿命や老化のメカニズムの研究を続ける中で、オートファジーに着目した研究を行うようになった」と続ける。
老化は、多くの疾患で最大のリスクファクターである。循環器疾患も認知症もがんも加齢とともに発症リスクが増大する。中村氏は「一つの疾患を治しても、すぐに別の加齢性疾患に罹患するという現状があるが、老化メカニズムの根本を解明して介入することができれば、多くの疾患の発症リスクを同時に下げ、健康寿命を延伸することができる」と指摘する。
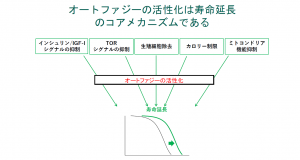
近年、モデル生物の研究から寿命や老化を決定する要因が明らかになってきた。例えば、線虫の寿命は通常3週間だが、インシュリン/IGF-1シグナル低下変異体遺伝子を持つ個体は約2倍の寿命を持ち、老化も抑制される。同じ現象は他のモデル生物でも報告され、ヒトの百寿者研究でもインシュリン/IGF-1シグナル関連遺伝子の多型が報告されている。
「インシュリン/IGF-1シグナルを大きく抑えると糖尿病になるが、少しだけ抑えると寿命延長につながる。同じような寿命延長経路として、TORシグナルの抑制、生殖細胞除去、カロリー制限、ミトコンドリア機能抑制などがあることも分かってきた。ただ、それらの経路に直接介入するのは、それぞれリスクや困難さを伴う」と中村氏。
そこで、着目されているのが「オートファジーの活性化」だ。
モデル生物を用いてこれらの寿命延長経路の実験を行うと、いずれの場合もオートファゴソームの増加、すなわちオートファジーの活性化が観察される。逆に、人為的にオートファジーの活性化を抑制すると、インシュリン/IGF-1シグナル抑制やカロリー制限をしても寿命延長は起こらなくなった。「すなわち、オートファジーの活性化は寿命延長のコアメカニズムである」(図3)と中村氏は強調する。
加齢で変化するオートファジー抑制因子、活性化因子
オートファジーの活性は、加齢に伴って低下することが分かっている。中村氏らは線虫、マウス、培養細胞を用いて、オートファジーを抑制する因子Rubiconに着目した研究を行い、加齢とともにRubiconが増加することを明らかにした。
線虫やショウジョウバエでRubiconを人為的に抑制するとオートファジーが活性化して寿命が延長し、Rubiconノックアウトマウスではオートファジー活性化とともに腎臓の線維化抑制、パーキンソン病の原因タンパク質の凝集抑制が示された。
さらに、中村氏らはヒトの腎組織や細胞を用いた実験で、グルコースの調節機能で知られている転写因子MondoAがRubiconを抑制することを見い出し、2022年に論文発表した。この実験では高齢者の細胞では若年者の細胞よりRubiconが増加し、MondoAが減少していることが示された。中村氏らはMondoAの活性化が個体や細胞の老化を防ぐことも明らかにしている。
「つまり、MondoAを活性化するか、Rubiconを抑制するか、いずれかの方法で老化抑制が期待できると考えられる。これらを制御する手法についても研究を進めている」と中村氏。
同時に取り組んでいるのが、全身のオートファジーを活性化させる鍵になる組織の研究だ。線虫を用いてさまざまな臓器・組織の細胞のオートファジーを抑制したり、活性化したりする実験を行ったところ、「神経のオートファジーの活性化を起点に他の組織のオートファジーも活性化することが分かった」という。
中村氏は、「オートファジーによる老化抑制のエビデンスはほとんどモデル生物によるもので、ヒトでのエビデンス構築はこれから。ヒトでオートファジー活性を評価する方法も確立していない」と課題を述べ、「奈良医大では学内の臨床講座や企業、国内外の研究者と連携してヒトでのエビデンスを構築し、最終的に疾患の予防・診断・治療につながる成果を社会還元することを目指す」と語る。
例えば、ターンオーバー周期が長い神経細胞はオートファジーによる老化抑制効果がクリティカルに表れると考えられるが、中村氏は同大脳神経内科と共同でヒト検体を用いた研究も進めている。
過去の記事
-
最先端のプロテオーム解析技術を用いて、進行胃がんの新たな治療標的を同定

国立研究開発法人 医薬基盤・健康・栄養研究所 創薬デザイン研究センター 副センター長 足立 淳氏(創薬標的プロテオミクスプロジェクト) -
研究機関の培養細胞の4分の1が

マイコプラズマに感染、定期的な検査が必須
医薬基盤・健康・栄養研究所 創薬資源研究支援センター長 小原有弘氏 -
薬物動態を解析するマルチ臓器モデルとMPSの冷蔵流通技術の開発を推進

群馬大学大学院 理工学府 教授 佐藤記一氏 -
カロリー制限による老化抑制の新たな分子メカニズム発見

東京理科大学教授 樋上賀一氏(薬学部 分子病態・代謝学研究室) -
遺伝子を使って花や野菜や果物を自由にデザインする

名古屋大学 准教授 白武勝裕氏(大学院生命農学研究科 園芸科学研究室)