研究・開発の窓 COLUMN
小児の白血病を引き起こす分子メカニズムの解明から革新的創薬へ
国立がん研究センター 鶴岡連携研究拠点 チームリーダー 横山明彦氏
 小児がんの40%以上を占めるのが白血病やリンパ腫などの血液がんである。国立がん研究センター鶴岡連携研究拠点のチームリーダー・横山明彦氏は小児白血病のメカニズム解明や治療法開発に取り組む研究者だ。
小児がんの40%以上を占めるのが白血病やリンパ腫などの血液がんである。国立がん研究センター鶴岡連携研究拠点のチームリーダー・横山明彦氏は小児白血病のメカニズム解明や治療法開発に取り組む研究者だ。
その研究成果から生み出された治療薬候補化合物は、現在、大手製薬企業によって臨床試験が進められている。国立がん研究センター鶴岡研究拠点は、2017年に地方創生事業の一環として同センターの研究機能の一部を移転して誕生し、慶應義塾大学先端生命科学研究所や山形県、鶴岡市などと連携し、メタボローム解析技術を応用したがん研究を推進している。
同センターでは2つの研究プロジェクトが進行しているが、横山氏をリーダーとするチームの研究テーマが小児がん・血液がんの創薬研究である。横山氏は、「小児がんの多くは未だに難治であり、治療に伴う晩発性障害に苦しむ場合も多い。全ての小児がんにおいて優れた治療法開発が求められている。一方で患者数が少ないために創薬や臨床開発が難しいという側面があり、アカデミアが取り組むべき役割として特に小児がんにフォーカスした研究を行ってきた」と研究の意義を語る。
続けて「遺伝子変異は加齢に伴って増加するため、小児がんは遺伝子変異が少ないという特徴がある。遺伝子変異が少数であれば発症のメカニズムが理解しやすく、分子標的薬の開発もしやすいのではないかと考えている」と強調。
その上で、「一般的な創薬の道筋とは異なるかもしれないが、われわれは小児がんの研究から創薬を進め、同じ遺伝子変異の成人にも適用することを目指している」と横山氏は話す。
白血病は未熟な血液細胞(白血病細胞)が無制限に大量増殖し、臓器に浸潤して血液系や免疫系を破壊する疾患である。造血幹細胞は数段階の分化過程を経て、さまざまな機能を持った各種の血液細胞になるが、健常人では造血幹細胞のみが自己複製能を持ち、一段階でも先に分化した細胞は自己複製できなくなる。
だが、本来は自己複製できない段階に進んだ細胞に何らかの遺伝子変異が起こると自己複製能を持つことがあり、分化しなくなった未熟な血液細胞がどんどん増殖していく。これが白血病であり、発症に関連するいくつもの遺伝子変異が報告されている。
横山氏らはその中でもMLL fusion(MLL融合遺伝子)と呼ばれる遺伝子変異を研究してきた。MLL fusionは11番染色体のMLL遺伝子が損傷を受け、遺伝子の一部が別の染色体上にある別の遺伝子の一部と融合する「転座」という現象で形成される(図1)。融合する相手方の遺伝子は100種類近くが報告されている。
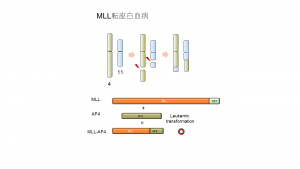
これまでの研究により、MLL fusionがある白血病(MLL転座白血病)は強力な化学療法に対しても抵抗性を示すことが多く、特に予後が悪いことが分かっている。また、MLL fusionは小児の白血病で高率に見られる変異であり、乳児の急性リンパ性白血病では80%にあるとされる。一方で、MLL fusionは成人にも見られ、全年齢では急性白血病の5~10%に出現すると言われている。
「なぜ、MLL転座白血病が特に予後不良であるのかという理由ははっきりと解明されていない。私見だが、MLLは非常に広範な遺伝子の発現に関与するため、白血病細胞が環境に適応して多様に変化し、薬剤耐性の獲得につながってしまうのではないかと考えている。だからこそMLLを標的とする治療薬の登場が待たれる」と横山氏は述べる。
研究成果に基づくMenin-MLL結合阻害剤の臨床試験がスタート
横山氏はMLL fusionがコードするタンパク質(MLL融合タンパク)が白血病発症につながるメカニズムの解明と、創薬標的の探索研究に取り組んだ。国立がん研究センターにおいて、MLLの機能解析研究がスタートしたのは1998年のことである。
「われわれの研究で、MLL融合タンパクは、まずMeninというタンパクと結合し、次の段階でMenin を介してLEDGFというタンパクと結合し、複合体を形成して白血病関連遺伝子を活性化させて白血病を引き起こすことが分かった(図2)」と横山氏は説明する。
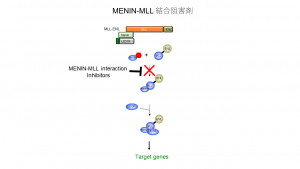
その成果をもとに取り組んだのが、このタンパク複合体の形成過程を阻害する創薬研究である。横山氏は創薬標的をMLL融合タンパクとMeninタンパクの結合阻害に定め、MLL遺伝子中のMenin結合部位(MBM)を特定した。
「MLLとMeninの結合を阻害することで、下流にあるLEDGFとの結合も白血病関連遺伝子の活性化も阻害できる。また、MBMはMLL遺伝子が他の遺伝子と融合する領域とは離れているので、融合した相手方の遺伝子が何であっても阻害できる」と横山氏は説明する。
続いて横山氏はMBMを欠損させ、Meninタンパクと結合できなくしたMLL融合タンパク変異体を作製し、さまざまな実験を行った。
マウスの細胞を用いたin vitroの比較実験を行うと、MLL融合遺伝子導入細胞ではどんどん増殖するのに比して、同変異体遺伝子を導入した細胞では全く増殖しなかった。また、これらの遺伝子導入細胞を直接、マウスに移植したin vivo実験でも、MLL融合タンパク移植マウスは白血病を発症して200日後に6割が死亡したが、MBM欠損MLL融合タンパク変異体移植マウスは白血病を発症せず、全例生存していた。この研究成果は2005年に論文掲載された。
こうした研究からMenin-MLLの結合を阻害する薬剤がMLL転座白血病の治療薬になり得るとの確信を得た横山氏は、京都大学在職中の2011年に大日本住友製薬(現・住友ファーマ)との共同研究をスタートした。共同研究は横山氏が国立がん研究センターに戻ってからも継続され、その間に創製されたMenin-MLL結合阻害剤の開発化合物DSP-5336のフェーズ1/2試験が2022年3月から北米と日本で開始されている。
Menin-MLL結合阻害剤は他にも開発を進める企業があり、MLL遺伝子に関連する他の創薬標的の研究も世界中で繰り広げられているという。
「マウスの細胞によるin vitro実験では、DSP-5336をMLL転座白血病細胞に添加すると白血病細胞が再び分化して無害な正常の血液細胞になること、DSP-5336はMLL転座白血病細胞に特異的に作用することが示された。副作用が少ない薬になる可能性が高いと期待して臨床試験を見守っている」と横山氏は話す。
さらに「Menin-MLL結合阻害剤を世に出せたとしても、二の矢、三の矢となるMLL fusionsを標的とした治療薬を開発する必要がある」と述べるとともに、「今後も小児がんのメカニズムを明らかにして産業界と一緒に薬を創りたい。そして小児がんになっても健康に長生きできる世の中にしたい」と夢を語った。
過去の記事
-
最先端のプロテオーム解析技術を用いて、進行胃がんの新たな治療標的を同定

国立研究開発法人 医薬基盤・健康・栄養研究所 創薬デザイン研究センター 副センター長 足立 淳氏(創薬標的プロテオミクスプロジェクト) -
研究機関の培養細胞の4分の1が

マイコプラズマに感染、定期的な検査が必須
医薬基盤・健康・栄養研究所 創薬資源研究支援センター長 小原有弘氏 -
薬物動態を解析するマルチ臓器モデルとMPSの冷蔵流通技術の開発を推進

群馬大学大学院 理工学府 教授 佐藤記一氏 -
カロリー制限による老化抑制の新たな分子メカニズム発見

東京理科大学教授 樋上賀一氏(薬学部 分子病態・代謝学研究室) -
遺伝子を使って花や野菜や果物を自由にデザインする

名古屋大学 准教授 白武勝裕氏(大学院生命農学研究科 園芸科学研究室)




