研究・開発の窓 COLUMN
肝がん、動脈硬化、認知症などの疾患とコンドロイチン硫酸合成異常の関連を解明
神戸薬科大学 学長・教授北川裕之氏(生化学研究室)
 近年、GAG(グリコサミノグリカン)と称される硫酸化糖鎖の生物学的機能が注目されるようになった。神戸薬科大学の北川裕之学長(生化学研究室教授)は、コンドロイチン硫酸などのGAGの合成異常が、全身のさまざまな疾患の発症や進展に関与することを解明し、創薬や未病段階での病気の発症の予防に応用する研究を続けている。
近年、GAG(グリコサミノグリカン)と称される硫酸化糖鎖の生物学的機能が注目されるようになった。神戸薬科大学の北川裕之学長(生化学研究室教授)は、コンドロイチン硫酸などのGAGの合成異常が、全身のさまざまな疾患の発症や進展に関与することを解明し、創薬や未病段階での病気の発症の予防に応用する研究を続けている。
GAGの多くはタンパク質と結合し、プロテオグリカンと呼ばれる糖タンパク質として存在する。プロテオグリカンは化粧品やサプリメントの有効成分として利用されているので、ご存知の方も多いのではないだろうか。GAG以外の糖鎖もタンパク質と結合した糖タンパク質として存在するが、一般的な糖タンパク質に結合した糖鎖と、プロテオグリカンに付加したGAGでは、そのはたらきに大きな違いがある。
北川氏は「一般的な糖タンパク質の糖鎖は、これが結合したコアタンパク質のフォールディング状態を示す指標となったり、目的地へコアタンパク質を輸送する荷札としての役割を果たしたり、コアタンパク質の性質を水溶性に変え、活性化したりするなど、タンパク質のはたらきを補助する脇役のイメージだが、プロテオグリカンのGAGは、GAGそのものがシグナル分子として受容体などと直接結合し、細胞内に情報を入力するため、機能発現の主役というべき働きを担っている」と説明する。
北川氏は米国留学時代にGAGの一つであるヘパリンが、タンパク質に結合せずに糖鎖単体で抗凝固作用を発揮することに驚き、GAGの研究に本格的に取り組むことを決めたという。
GAGは、二糖を1単位としたポリマーで、二糖単位が数十回から数百回繰り返された直鎖状の構造を基本骨格とする。基本骨格は単純であるが、構成糖のヒドロキシ基が硫酸化による修飾を受け構造に多様性がもたらされる。「硫酸基がどこにどれだけ付いているかという硫酸化パターンをタンパク質が認識するため、GAGの硫酸化構造が機能発現の情報を内包する機能ドメインを形成する。したがって、正しい場所で正しい硫酸化構造をもったGAGが合成されなくなると、さまざまな疾患の発症につながることを、これまでの研究で見い出してきた」と北川氏は話す。
GAGにはヘパラン硫酸、コンドロイチン硫酸(CS)、デルマタン硫酸などと幾つかの種類があるが、その中でも、北川氏がフォーカスしてきたのがCSである。CSは軟骨のクッション成分として有名だが、骨・軟骨だけでなく、脳・神経細胞、血管内皮細胞、肝細胞、筋肉細胞、皮膚表皮細胞、卵細胞、がん細胞など、体を構成するほとんどすべての細胞の表面や細胞外マトリックスに豊富に存在する。同じCSであっても硫酸化構造の違いにより全く異なる機能をもつ場合がある。
また、1本のCS鎖の中に異なった機能特性を示す硫酸化構造が含まれる場合もあるため、それぞれの組織や細胞のはたらきを制御するために必要な硫酸化構造をもったCSがつくられるように、CS生合成系は厳密に調節されている。そのため、CSの生合成異常は、骨粗鬆症、統合失調症、うつ、認知症、動脈硬化、肝がん、サルコペニア、乾癬、不妊症、がんの転移など、さまざまな疾患と密接に関連することが指摘されている(図1)。
「コンドロイチン硫酸の量の変化や硫酸化構造の変化が、どのようなシグナル異常を引き起こして疾患を発症・進展させるのか、私たちはCSを基軸とした疾患発症メカニズムの解明と介入手段の基礎的研究に取り組んでいる」と北川氏は述べるとともに、「CSは糖転移酵素と硫酸基転移酵素の働きで合成されるので、これらの酵素を活性化する、または抑制することができれば、CSの生合成をコントロールできる」と続ける。
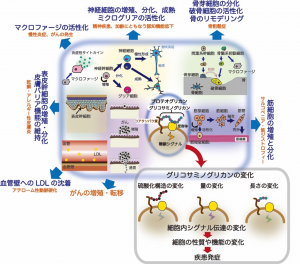
図の中央の楕円内に示されたように、グリコサミノグリカンは受容体を介して細胞内にシグナルを入力し、神経細胞、骨芽細胞、破骨細胞、筋細胞、表皮幹細胞の増殖や分化、がん細胞の増殖や転移能を制御する。右下の枠内に示したように、グリコサミノグリカンの量、硫酸化構造、長さが変化すると、受容体との相互作用に影響が生じた結果、細胞内シグナル伝達が変化することで細胞の性質や機能が変化し、病気の発症につながる。なお、グリコサミノグリカンが制御する現象を紺色の文字で、グリコサミノグリカンの量、硫酸化構造、長さの変化に関連した疾患はオレンジ色の文字で示した。
北川氏の研究の一つが、非アルコール性脂肪肝炎(NASH)から肝細胞がんへの進行過程におけるCS合成異常の関与である。NASH患者のうち、肝細胞がんに進行する人としない人がいるが、その違いはどこにあるのか。北川氏は「NASHの進行に関わる代謝ネットワークデータベースとプロテオミクスデータを基にコンピューター上に再現したデジタル肝細胞を解析した論文で、NASHから肝細胞がんに進行した患者由来の肝細胞では健常者と比べてCS合成が上昇していることを示唆した報告があったことから、CSが肝細胞がんの発生に関与すると考え、その発症機序解明の研究に着手した」という。
北川氏は、遺伝子改変によりCSを過剰に合成するマウスを作出し、この遺伝子改変マウスと野生型マウスに膵β細胞毒性を持つストレプトゾシンを投与してI型糖尿病を引き起こした上で、高脂肪食を摂取させ、NASH-肝細胞モデルマウスを作製した。
CSを過剰に合成するマウスの脂肪肝、肝細胞の壊死、線維化の程度は野生型マウスと同程度であったにもかかわらず、野生型よりも早期に肝細胞がんを発症した。この原因は、CSを過剰に合成するマウスでは、CS量が増えているだけでなく、定常状態では合成されていない糖鎖構造をもつCSが合成されており、これが肝マクロファージのToll様受容体4(TLR4)を刺激し、炎症を引き起こすサイトカインの発現を促すからである。
このため、炎症が持続化し、がんの発生が促進すると考えられる。この研究結果は、NASH患者のうち、TLR4を刺激するCSを合成している人は、将来肝細胞がんを発生するリスクが高いことを示唆しており、CSの構造変化が肝細胞がんを発生するリスクの予測因子となる可能性がある。
コンドロイチン硫酸の構造変化が動脈硬化発症や認知機能低下に関連
CSは血管内皮でも重要な役割を担っている。一般的によく知られているアテローム性動脈硬化は、①血中の低比重リポタンパク質(LDL)コレステロールが血管内膜に入り込み、酸化LDLに変化する。②マクロファージがこれを取り込んで泡沫細胞に変化し炎症性サイトカインを放出することで炎症反応を惹起する。③これが引き金となり、平滑筋細胞が血管内膜内に遊走し増殖する。④内膜内に留まっている泡沫細胞は、血管内膜に浸潤した平滑筋細胞や線維芽細胞などとともにプラークを形成し、動脈を狭窄・閉塞するというプロセスを経て発症する。
だが血中LDL濃度が正常でも動脈硬化を発症する人や高LDL血症でも動脈硬化を発症しない人がいることから、近年では血管壁表面にLDLが沈着することが動脈硬化の始まりであるとする「貯留反応説」が唱えられている。血管壁の細胞には多くのCSプロテオグリカンが存在し、これがLDLの沈着に関与することが示唆されていたが、その機構の詳細は不明であった。
動脈硬化モデルマウス(LDL受容体遺伝子欠損マウス)に高脂肪食を摂食させると、動脈硬化の進展にともなってCS鎖の伸長に関与するCS合成酵素の発現が上昇し、CS鎖が長くなるという現象が見られた。北川氏は「CS鎖が長くなれば、それだけ多くのLDLが結合する。CS鎖が長く伸びることが動脈硬化を発症させる要因ではないか、CS鎖が短ければ動脈硬化にならないのではないか」という仮説を立てた。
この仮説を検証するために、CS鎖の伸長に関わる生合成酵素のうち、動脈硬化にともなって発現が上昇するCS生合成酵素に着目した。高脂肪食を摂取させて血中の脂質濃度を上昇させた場合、動脈硬化モデルマウスでは血管壁への脂質の貯留が強く認められたが、CS鎖の伸長に関わる生合成酵素を欠損させることで、脂質の沈着がほとんど認められなくなった。病変部の血管壁のCSをCS分解酵素で除去すると、脂質の血管壁への結合が消失したことから、血管内膜のCSが脂質の沈着を促進することが示された。
さらに、動脈硬化に関連して発現が上昇するCS合成酵素の発現を抑えてCS鎖の長さを短くするとマクロファージへの酸化LDLの取り込みが抑制されたことから、マクロファージ表面のCSはLDLと結合することで泡沫細胞への変化を促進することが明らかとなった。
このことから北川氏は「血管やマクロファージのCS鎖の長さを調節することで、脂質異常症の有無にかかわらず、動脈硬化症の発症や進展を予防できる可能性がある」と強調する。
冒頭でも述べたように、CSの機能発現には硫酸化構造が重要である。脳のCSの硫酸化構造は加齢にともない変化し、年を経るにつれ、6-硫酸化構造が減少し、4-硫酸化構造が増加する。北川氏は、このような硫酸化構造の変化が、加齢にともなう脳の認知機能低下に関与する可能性を考えた。
予想通り、6-硫酸化構造の合成に関わる酵素を欠損させたマウスでは若齢期から老齢マウスなみの認知機能の低下を示した。また、ウイルスベクターを利用し6-硫酸化構造の合成に関わる酵素を発現させた老齢マウスでは認知機能が回復した(図2)。
図2 加齢にともなう記憶認知機能の低下に関わるCSの硫酸化構造の変化
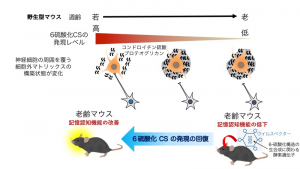
脳のCSは一部の神経細胞の周囲を覆う細胞外マトリックスに豊富に存在し、細胞外マトリックスの構築状態を制御する。若齢型の細胞外マトリックスは6硫酸化CSの含量が高く、粗な構築状態をとり、このような柔らかい細胞外マトリックスで覆われた神経細胞は、別の神経細胞とシナプスを形成することができる。一方、加齢にともないCSの6硫酸化構造が減少すると、固い細胞外マトリックスに変化し、別の神経細胞と新たにシナプスを形成することができない。そのため、新しく経験したことを記憶することが困難になる。6硫酸化CSの発現が低下した老齢マウスに、6硫酸化構造の生合成に関わる酵素遺伝子を導入すると、6硫酸化CSの発現の回復により記憶認知機能が改善する。
脳のCSは一部の神経細胞の周囲を覆う細胞外マトリックスに豊富に存在し、細胞外マトリックスの構築状態を制御する。若齢型の細胞外マトリックスは6硫酸化CSの含量が高く、粗な構築状態をとり、このような柔らかい細胞外マトリックスで覆われた神経細胞は、別の神経細胞とシナプスを形成することができる。一方、加齢にともないCSの6硫酸化構造が減少すると、固い細胞外マトリックスに変化し、別の神経細胞と新たにシナプスを形成することができない。そのため、新しく経験したことを記憶することが困難になる。6硫酸化CSの発現が低下した老齢マウスに、6硫酸化構造の生合成に関わる酵素遺伝子を導入すると、6硫酸化CSの発現の回復により記憶認知機能が改善する。
北川氏は、「われわれはCS量の増加・減少や硫酸化構造の変化が細胞の機能を変化させ、炎症やがん、老化関連疾患、脳の認知機能低下などさまざまな病気に関連することを明らかにしてきた」とこれまでの研究を総括するとともに、「今後、ヒトに応用することをめざして、CSの量や硫酸化構造を人為的に操作するために、糖転移酵素や硫酸基転移酵素の発現を増減できる低分子化合物や糖鎖そのものを用いた治療の実現に向けて基礎研究を展開している。候補物質は多いが、糖鎖は全身に分布しているだけに副作用の抑制、標的細胞へのターゲティングが課題となるだろう」と話している。
過去の記事
-
最先端のプロテオーム解析技術を用いて、進行胃がんの新たな治療標的を同定

国立研究開発法人 医薬基盤・健康・栄養研究所 創薬デザイン研究センター 副センター長 足立 淳氏(創薬標的プロテオミクスプロジェクト) -
研究機関の培養細胞の4分の1が

マイコプラズマに感染、定期的な検査が必須
医薬基盤・健康・栄養研究所 創薬資源研究支援センター長 小原有弘氏 -
薬物動態を解析するマルチ臓器モデルとMPSの冷蔵流通技術の開発を推進

群馬大学大学院 理工学府 教授 佐藤記一氏 -
カロリー制限による老化抑制の新たな分子メカニズム発見

東京理科大学教授 樋上賀一氏(薬学部 分子病態・代謝学研究室) -
遺伝子を使って花や野菜や果物を自由にデザインする

名古屋大学 准教授 白武勝裕氏(大学院生命農学研究科 園芸科学研究室)