研究・開発の窓 COLUMN
ライブイメージングを駆使した脳の神経回路研究を疾患の治療につなげたい
国立精神・神経医療研究センター 小山隆太氏(神経研究所 疾病研究第二部 部長)
マイクログリアが異常なシナプスを貪食する
 脳神経系はニューロン(神経細胞)とグリア細胞で構成される。かつては、神経ネットワークで中心的な役割を担うのはニューロンであり、グリア細胞は脇役と考えられてきたが、近年ではグリア細胞の研究が進み、シグナル伝達が行われるシナプスの構造や機能をグリア細胞が制御していることが分かってきている。
脳神経系はニューロン(神経細胞)とグリア細胞で構成される。かつては、神経ネットワークで中心的な役割を担うのはニューロンであり、グリア細胞は脇役と考えられてきたが、近年ではグリア細胞の研究が進み、シグナル伝達が行われるシナプスの構造や機能をグリア細胞が制御していることが分かってきている。
こうした中、国立神経・精神医療研究センターの小山隆太氏は、独自の細胞培養技術とライブイメージング技術を駆使し、グリア細胞の一つであるマイクログリアの機能や疾患との関連を解き明かそうとしている。
小山氏は「ニューロンとグリア細胞の相互作用に興味があって研究を開始したが、脳の病気になったとき、相互作用にどのような変化があるかが分かれば、発症メカニズムの解明や創薬に生かすことができる」と研究の意義を語る。
脳の神経ネットワークに関する近年の研究では、マイクログリアが、①シナプスの形成に関与する、②不必要なシナプスや異常なシナプスを貪食する、②シナプスを剥離してシグナル伝達を一時遮断する、④ニューロンの軸索側と樹状突起側に生じるシナプスにアストロサイトとマイクログリアが加わった4者間でもシナプスが形成される――といった報告が相次いでいる(図1)。
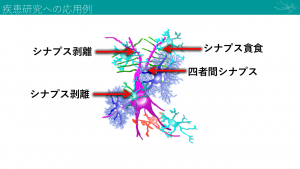
ピンク=ニューロン、水色=マイクログリア、紺色=アストロサイト、赤=オリゴデンドロサイト
ただ、こうした脳内細胞の微細な動きを、実際に目で見て確認することは困難だった。小山氏はハーバード小児病院留学時代に、動物の脳を使った実験でマイクログリアがシナプスを貪食する現象を発見した研究に貢献したが、その時点ではシナプス貪食の証拠は組織学的なものにとどまり、貪食の瞬間やそのプロセスまで示すことはできなかった。「固定標本では細胞は既に死んで動かない。生きた状態の細胞の動きや形態の変化をリアルタイムに動画で捉えることが重要だ」と小山氏は考えるようになった。
そこで、小山氏が目指したのは、超高解像度の共焦点レーザー顕微鏡と細胞培養技術を組み合わせたin vitroのライブイメージング技術の構築だった。生きた動物の脳を高解像度で観察することは難しいが、培養した細胞で生体に近い実験系を構築すれば超高解像度の顕微鏡システムを用いることができ、動画として解析できる。
ところが、マイクログリアを脳から単離して培養するだけではアメーバ状の形状をとってしまい、生体内に存在したときにあった多数の突起が生じない。この突起はマイクログリアがシナプスの機能を監視し、調節するために欠かせないものである。小山氏らは培地や培養条件を変えて試行錯誤を繰り返した末に、生体内の状態に近い構造と機能を有するマイクログリアの培養実験系を創り上げた。
マイクログリアのシナプス貪食をリアルタイム動画で確認
小山氏らはさらに培養技術を磨き、ニューロンとマイクログリアの機能を保ったまま共培養することに成功し、マイクログリアがシナプスを貪食する瞬間をライブイメージング動画で捉えることができた。 「マイクログリアのシナプス貪食の論文に対して、『シナプス部分だけを貪食することは不可能でニューロンの軸索を食いちぎって殺してしまうから、貪食という現象は起きない』という批判があったが、われわれはマイクログリアがシナプス部分だけを正確に貪食し、ニューロンの軸索は残されることを、一連のプロセスを捉えた動画で確認した」
また、小山氏らはアストロサイトが生体内と同様に密集した葉のようなリーフレット構造を形成する培養技術も開発した。リーフレット構造はニューロンのシナプスを包み込むように形成され、その中ではアストロサイト自身もシナプス近位で神経伝達物質の放出や受容を行っていることが分かっている。
従来の細胞培養技術ではリーフレット構造を形成させることができないという課題があったが、この技術によりリーフレット構造を含む細胞実験系の構築が可能となり、3者間シナプス、4者間シナプスの研究が進められるようになった。
さらに、小山氏らはニューロン、マイクログリア、アストロサイトを3次元的に共培養したスフェロイドの開発にも成功し、「グリオニューロナル・ユニット(グリア・ニューロン複合体)」と名付けた。生体脳に非常に近い形で神経伝達回路を再現したin vitroの実験系である。
小山氏は2024年に東京大学薬学部から国立精神・神経医療研究センターに移籍し、基礎と臨床をつなぐ研究に力を注いでいる。これまでメインとしてきたのは、脳の神経回路で起きている生命現象をライブイメージングで観察する研究であったが、新たに取り組み始めたのは細胞を人為的に操作したときの反応をライブイメージングで見る研究である。
「例えば、マイクログリアにアミロイドβを貪食させる研究だ。われわれの実験系を用いて貪食能力を高めるような操作ができれば、神経変性疾患の新たな治療法につながるかもしれない」と小山氏。
マイクログリアの貪食機能で脳神経疾患に関与するさまざまな異常タンパク質を取り除くことができる可能性を示唆しつつ、「一つの仮説に囚われることなく、多様な操作を行ってグリア細胞の能力を見定め、限界突破させる実験を行いたい」と述べる。
次の段階で目指すのは、細胞実験系脳疾患モデルの構築だ。小山氏は「グリオニューロナル・ユニットなどの細胞実験系で疾患モデルを作製し、情報科学を駆使した手法で動物の脳やヒトの臨床データとの類似性評価を行えば、高い確度で疾患を忠実に再現したモデルが構築できる」との考えを強調する。
その上で、「そうなれば動物実験の代替にもなり、多くの脳神経疾患の発症メカニズム解明や創薬スクリーニングに貢献できるようになるだろう」と夢を語った。
過去の記事
-
消化管全体の生理環境と薬物動態を考慮した革新的な薬物吸収性予測モデルを開発する

昭和薬科大学 薬学部 教授 白坂善之氏
(薬剤学研究室) -
プロテオーム解析を起点に老化関連疾患の病態機序や健康長寿の因子を探索

東京都健康長寿医療センター研究所 研究部長 三浦ゆり氏(老化機構研究チーム プロテオーム研究) -
バイオ医薬品の経口投与や効率的脳内移行を実現する「組織関門透過ペプチド」を発見

熊本大学大学院 生命科学研究部 准教授
伊藤慎悟氏 -
食品の機能性成分を分子・細胞レベルで解析し、「食による病気の予防」を目指す

群馬大学大学院 食健康科学研究科・理工学府 教授 薩秀夫氏 -
新たな遺伝子改変技術で長鎖ノックインマウスの高効率な作製に挑む

東京大学大学院農学生命科学研究科
助教 藤井渉氏