研究・開発の窓 COLUMN
カロリー制限による老化抑制の新たな分子メカニズム発見
東京理科大学教授 樋上賀一氏(薬学部 分子病態・代謝学研究室)
GH/IGF-1シグナル抑制非依存的なメカニズム
 1935年に米国のMcCayらが、カロリー制限(CR= caloric restriction)でラットの寿命延伸と老化関連疾患の発症抑制を報告して以来、世界中の多くの研究機関でカロリー制限と老化抑制の研究が進められている。
1935年に米国のMcCayらが、カロリー制限(CR= caloric restriction)でラットの寿命延伸と老化関連疾患の発症抑制を報告して以来、世界中の多くの研究機関でカロリー制限と老化抑制の研究が進められている。
東京理科大学薬学部教授の樋上賀一氏は、以前からカロリー制限の分子メカニズムとして知られている「成長ホルモン(GH)とそれによって誘導されるインスリン様成長因子(IGF-1)の抑制(=GH/IGF-1シグナル抑制)」以外に、「白色脂肪組織中のミトコンドリア生合成の亢進」という新たな分子メカニズムがあることを発見し、注目を集めている。
樋上氏が「カロリー制限」を研究テーマとするようになったのは偶然のできごとに近い。母校の長崎大学医学部の準硬式野球部で活躍した樋上氏は、同部の部長が病理学の教授であった縁で大学院では病理学を専攻した。最初に与えられたテーマである脳腫瘍の研究に行き詰っていた時期、病理学教室の先輩が留学していた米国テキサス大学サンアントニオヘルスサイエンスセンター生理学教室のEdward J Masoro教授とByung Pal Yu教授の研究室に先輩と入れ替わりで留学することになった。
同研究室は、当時、ラットを用いた老化研究の世界的研究拠点であり、与えられた研究テーマがCRによる病理学的な加齢変化の抑制に関する研究であったという。
「カロリーを摂取しすぎると肥満になり、寿命が短くなる。極端に制限しすぎると寿命は短くなる。寿命を延伸する最適な摂取量があるが、その摂取量を変化させることで起きる病理的変化を調べることで老化のメカニズムを解明するという研究手法だった」と樋上氏。米国で何本か論文を書いて研究が楽しくなり、帰国して長崎大学に戻った後もCRの研究を継続することにしたという。
樋上氏は「1990年代後半から、CRによって変異する遺伝子と寿命延伸の報告が相次ぎ、これまでに哺乳類で30~40の単一遺伝子変異と寿命延伸の報告がある。そのうち半数程度はGH/IGF-1シグナル抑制に関与する遺伝子だ」と指摘する。
その後、樋上氏は東京理科大学に移籍した2007年頃から、GH/IGF-1シグナル非依存的な分子メカニズムの解明に軸足を移した。「独自の研究をしたい」という思いがあったとともに、過去の研究で成長ホルモンを遺伝子操作で抑制したラットが寿命延伸することを報告した際に、「寿命が伸びたラットにCRを加えると、そこからさらに寿命が伸びる」ことを確認していたからだ(図1)。
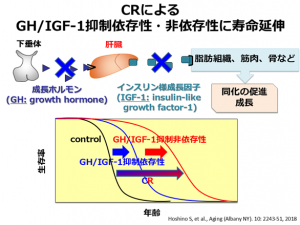
つまり、GH/IGF-1シグナル抑制の経路とは別のメカニズムが存在すると推測できる。また、「将来、研究成果をヒトの健康寿命延伸のために外挿することを考えると、GHやIGF-1は骨格筋や骨の維持にも重要なため、それらを抑制する介入を行うのは適当ではないと考えられる」と、GH/IGF-1シグナル抑制非依存的な老化抑制メカニズム研究の意義を語る。
CRによる寿命延伸にはSREBP-1C が重要
樋上氏は、「CRをすると、白色脂肪細胞は小さくなる。形態学的変化も遺伝子発現の変化も最も大きいのが白色脂肪組織である」として、白色脂肪組織で起きるCRによる遺伝子発現と、成長ホルモン抑制による遺伝子発現の違いを網羅的に解析した。
この研究の結果、成長ホルモン抑制ではあまり変化しないが、CRで増加する遺伝子として見つけたのがSREBP-1Cである。SREBP-1C は肝臓や白色脂肪細胞に多く発現して脂肪酸合成関連遺伝子を正に制御する転写因子であり、従来は脂肪肝の増悪因子として知られていた。樋上氏はSREBP-1C ノックアウト(KO)マウスを用いてCRの実験を行った。
その結果、野生型(Wd)マウスでは自由摂食群(AL)に比してCR群の寿命が1.2倍に延伸したが、SREBP-1C KOマウスではどちらの寿命も同じで、CRの寿命延伸効果が見られなかった(図2)。
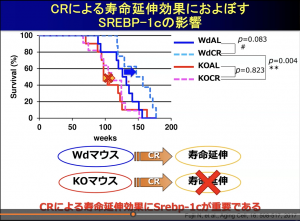
「つまりCRによる寿命延伸にはSREBP-1C が重要である」と樋上氏は結論付け、次にSREBP-1C KOマウスと野生型マウスにCRを行ったときの各臓器(肝臓・白色脂肪細胞・心臓・骨格筋・腎臓)での代謝関連遺伝子の変化を研究した。その結果、白色脂肪細胞において、野生型マウスにCRを行うと脂肪酸合成、酸化ストレス抵抗性、ミトコンドリア生合成が大きく亢進したが、SREBP-1C KOマウスではほとんど影響が出なかった。
この中で、樋上氏が着目したのがミトコンドリアの生合成亢進である。「CRによって白色脂肪細胞のミトコンドリアの量が増えることは報告されていたが、われわれの研究により、SREBP-1C をノックアウトすると、CRをしてもミトコンドリアの生合成亢進が起こらないことが分かった」
樋上氏らはさらに研究を続け、SREBP-1cがミトコンドリア生合成に重要な因子であるPGC-1αという転写補助因子を制御していることを発見して論文発表した。また、樋上氏はSREBP-1cがミトコンドリアタンパク質の成熟プロセスに与える影響を研究。CRによるSREBP-1cの亢進がMIPEPというミトコンドリアタンパク質切断酵素を介して、サーチュインタンパク質の一つで、ミトコンドリアに含まれる多くの酵素の活性を制御するSIRT3を活性化することを明らかにした。
これらの研究結果から、樋上氏が考えるCRによる脂肪細胞の代謝リモデリングは図3の通りである。
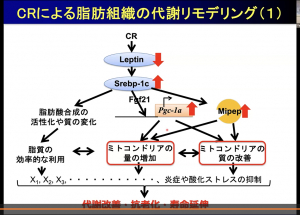
「SREBP-1c が制御するPGC-1αとMIPEPという2つのタンパク質が重要である。PGC-1αは特にミトコンドリアの量を増やすことが分かっている。MIPEPの機能は解析中だが、おそらく質の改善に関わっていると考えている」と樋上氏。現在は脂肪細胞特異的MIPEPノックアウトマウスを作成し、解析を進めている。
樋上氏の最終的な目標は、研究成果を応用して肥満症やメタボリック症候群、生活習慣病、ミトコンドリア機能と関連するパーキンソン病などの発症・進展を予防できるような薬を開発することだ。「上流にあるSREBP-1cを増やすのは脂肪肝の増悪につながるので創薬標的にするのは難しいが、PGC-1αやMIPEPは創薬標的になるのではないかと考えている。脂肪細胞特異的に作用させるDDSの開発も必要になるかもしれない」と樋上氏は話す。
過去の記事
-
新しい理論「生物力学」とAIを活用した汎用疾患予測モデルを開発

慶応義塾大学医学部 教授 桜田一洋氏(石井・石橋記念講座/拡張知能医学) -
最先端のプロテオーム解析技術を用いて、進行胃がんの新たな治療標的を同定

国立研究開発法人 医薬基盤・健康・栄養研究所 創薬デザイン研究センター 副センター長 足立 淳氏(創薬標的プロテオミクスプロジェクト) -
研究機関の培養細胞の4分の1が

マイコプラズマに感染、定期的な検査が必須
医薬基盤・健康・栄養研究所 創薬資源研究支援センター長 小原有弘氏 -
薬物動態を解析するマルチ臓器モデルとMPSの冷蔵流通技術の開発を推進

群馬大学大学院 理工学府 教授 佐藤記一氏 -
遺伝子を使って花や野菜や果物を自由にデザインする

名古屋大学 准教授 白武勝裕氏(大学院生命農学研究科 園芸科学研究室)